La pourriture fusarienne de la tige et des fruits chez le poivron de serre
Renseignez-vous sur les symptômes, le cycle de la maladie, les méthodes de lutte, les méthodes culturales et la prévention associés à la pourriture fusarienne de la tige et des fruits dans les poivrons de serre.
Introduction
Au Canada, la pourriture fusarienne de la tige et des fruits a été signalée en 1991 chez le poivron cultivé dans des serres commerciales en Ontario et en Colombie-Britannique. Elle a provoqué des pertes de plants et de rendement en fruits de 5 % environ. L'organisme pathogène, Fusarium solani, peut s'attaquer à un large éventail de plantes, y compris les légumes de serre. De nombreuses races physiologiques, adaptées à des hôtes spécifiques, ont été reconnues.
Symptômes
On voit apparaître des chancres mous, brun foncé ou noirs, sur la tige, en général au niveau des noeuds ou des plaies (figure 1). Ces chancres peuvent faire le tour de la tige dans les derniers stades de la maladie. Une tache brun foncé colore l'intérieur de la tige et peut s'étendre sur une longueur considérable (figure 2). Pour finir, on voit apparaître, sur les lésions, des structures de couleur cannelle ou orange pâle, minuscules (< 1 mm de diamètre), en forme d'ampoule, que l'on appelle les périthèces et qui sont les fructifications du champignon pathogène (figure 3).



À la surface des chancres de la tige, dans les derniers stades de la maladie, on peut aussi observer la présence de mycélium, une masse cotonneuse blanche, qui représente le stade imparfait du champignon (figure 4). Les chancres de la tige entravent le passage de l'eau vers le haut de la plante, qui, mal irriguée, finit par flétrir (figure 5) et mourir. Sur les fruits, on peut voir aussi apparaître, d'abord autour du calice, des taches aqueuses noires (figure 6). Les taches grossissent, se rejoignent et recouvrent les flancs des fruits. Le mycélium se développe abondamment lorsque l'ambiance de la serre est très humide et en particulier quand la température dépasse 25 ° C. Des marbrures similaires à celles de la carence en magnésium peuvent apparaître sur les feuilles des plantes atteintes. Les premiers symptômes de la maladie sur la tige ressemblent beaucoup aux symptômes déterminés par Erwinia carotovora carotovora qui est responsable du chancre bactérien de la tige et du pédoncule chez le poivron (figures 7 et 8).





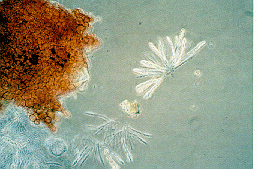
Cycle évolutif de la maladie et conditions de milieu
Le cycle de développement du champignon comporte deux stades que l'on rencontre simultanément sur les tissus du collet et de la tige. Le stade parfait (Nectria haematococca) est celui où se produit la recombinaison sexuée et où les spores du champignon, les ascospores, se forment dans les périthèces couleur cannelle (figure 9). Les périthèces sont les fructifications en forme d'ampoule qui se développent sur la tige durant les derniers stades de la maladie, lorsque l'ambiance de la serre est très humide. La recherche menée en Colombie-Britannique a permis de voir que, durant la nuit, les périthèces libèrent les spores et les projettent sur une distance de 1 ou 2 m, et que ce phénomène est le principal mode de dissémination naturelle des spores à l'intérieur des serres en Colombie-Britannique. La libération des spores la nuit est plus favorable au développement de la maladie puisque c'est la nuit que se produisent les périodes de forte humidité relative et même la rosée. Les autres spores, les conidies, se forment en grands nombres selon un mode asexué au cours du stade imparfait (Fusarium solani), et ne sont pas projetées mais transmises passivement. Elles ne jouent donc pas un rôle aussi important dans la propagation naturelle de la maladie dans les serres en Colombie-Britannique. Les conidies peuvent être dispersées par l'eau éclaboussée, les couteaux de taille et autres outils, les vêtements ou les mains des employés.
La germination des ascospores se produit durant des périodes prolongées de forte humidité (supérieure à 95 %). Les expériences menées en serre montrent que durant les périodes où l'humidité relative est égale ou supérieure à 90 % à l'intérieur de la serre, elle est en fait encore plus élevée à la surface de la feuille et par conséquent favorable à la germination des ascospores de Nectria haematococca. Une élévation rapide ou tardive (après le lever du soleil) de la température dans la matinée peut provoquer la formation de rosée et créer des conditions propices à la germination des ascospores, parce que la température du point de rosée dépasse celle des fruits et de la tige. En élevant lentement la température (1 ° C par heure), très tôt le matin, on s'assure que les fruits et les tiges atteignent les températures diurnes voulues avant le lever du soleil. En outre, si la ventilation et le drainage de la serre ne sont pas satisfaisants, il peut se créer un climat « humide » que N. haematococca peut mettre à profit pour la germination de ses ascospores. Quand des périthèces sont présents sur les blocs de laine minérale ainsi que sur les lésions des fruits, la production d'inoculum aérien est encore plus forte, surtout quand l'ambiance de la serre est « humide », et provoque de nombreux points d'infection sur les fruits et les tiges. D'autres facteurs tels que l'irrigation excessive des blocs de laine minérale peuvent stresser les plantes en les privant d'oxygène et augmenter l'incidence des lésions du collet. Par conséquent, il est possible de réduire l'incidence de la maladie en surveillant rigoureusement les conditions d'ambiance dans la serre, de façon qu'il ne se produise pas des périodes prolongées d'humidité relative élevée, et en réglant soigneusement le débit de l'irrigation goutte à goutte, pour éviter une humidité excessive dans les blocs de laine minérale, même si le champignon s'y trouve déjà au début de la saison.
Les ascospores à la surface des plantes peuvent survivre plusieurs jours dans des conditions climatiques défavorables jusqu'à ce qu'elles trouvent l'humidité libre ou une ambiance nettement saturée qui favorisera l'infection. Par contre, les spores ne survivent pas à une période de 3 à 6 semaines en l'absence d'une culture. Les journées très chaudes où l'humidité relative fluctue ne sont pas propices à la survie des ascospores.
Fusarium solani est extrêmement commun dans les sols du Canada et envahit fréquemment les tissus végétaux morts ou sénescents (c'est un champignon saprophyte). Il peut produire certaines spores hivernantes, les chlamydospores, qui peuvent rester viables pendant des années. Le champignon peut envahir les tiges du poivron au niveau des noeuds ou du sol, à la faveur des blessures de taille ou des lésions causées par l'excès de sels. Les plantes herbacées à croissance rapide sont les plus sensibles, et les fruits mûrissants sont plus sensibles que les fruits verts. Les fruits qui ont une blessure, surtout autour du calice, sont très sensibles à l'infection. La pourriture peut continuer ses méfaits durant l'entreposage, mais elle épargne en général les fruits en bonne santé qui ne sont pas endommagés. Le champignon peut envahir les fruits tombés ou avortés et les fleurs sénescentes.
Les producteurs de la Colombie-Britannique ont observé l'apparition de fructifications du champignon sur les blocs de laine minérale qui sont apportés dans la serre après la multiplication et durant les premiers stades de développement des plantes. Les blocs de laine minérale permettent au champignon de survivre à des périodes où le climat de la serre lui est défavorable durant la saison de culture. Quand les conditions deviennent favorables à la libération des spores et à l'infection des fruits, les fructifications présentes sur les blocs de laine minérale peuvent libérer les ascospores. Étant donné qu'ils sont constamment humides, les blocs de laine minérale offrent des conditions idéales pour la libération des spores, même si le climat de la serre n'est pas vraiment favorable.
L'organisme pathogène peut aussi être introduit accidentellement par le biais des outils et des machines transportant des débris végétaux malades depuis les serres voisines. Les employés peuvent colporter les spores sur leurs chaussures et leurs vêtements quand ils passent d'une zone contaminée à une zone sans symptômes, ou d'une serre à une autre.
L'infection sans extériorisation de symptômes (infection latente) peut toucher les tissus du collet et les symptômes ne deviendront visibles que 2 ou 3 mois plus tard, à la fin de la saison. Les symptômes se déclencheront chez les plantes qui subissent un stress parce qu'elles sont surchargées de fruits, que les conditions d'ambiance sont mauvaises, ou à cause de la sénescence.
Méthodes de lutte
On peut lutter contre la pourriture fusarienne chez le poivron de serre en associant dans un programme intégré des méthodes culturales et biologiques, la prévention, l'hygiène et la gestion de l'environnement.
Méthodes culturales
- Il faut veiller à ne pas laisser la partie supérieure des blocs de laine minérale se dessécher, car il peut en résulter une accumulation dommageable de sels d'engrais évaporés au pied de la plante, et donc un terrain propice à l'infection.
- Éviter que le goutte à goutte ne distribue la solution fertilisante trop près du pied de la plante en le positionnant suffisamment à l'écart.
- Éviter les fortes doses d'engrais qui contribuent aux dégâts par le sel.
- Éviter de faire cohabiter des cultures de poivron d'âge différent, car les spores de Nectria haematococca projetées dans l'air par la culture mûre risquent de se déposer sur les jeunes cultures.
Prévention
- Avant d'apporter des blocs de laine minérale dans la serre, il faut les inspecter soigneusement pour vérifier qu'il ne s'y trouve pas du mycélium ou des fructifications du champignon pathogène, pour ne pas introduire d'inoculum dans la serre. Plus tôt la maladie est détectée, plus on augmente les chances de l'éradiquer.
- Inspecter les plants de repiquage pour vérifier qu'ils ne présentent pas de symptômes tels que le flétrissement ou l'infection de la tige.
- Ne repiquer que des plants qui paraissent en bonne santé.
- Apporter les plants suspects à un spécialiste ou à un laboratoire de diagnostic phytosanitaire, car les symptômes avant-coureurs de l'infection de la tige ressemblent souvent à ceux causés par Erwinia carotovora carotovora, une maladie bactérienne du poivron.
- S'assurer que tous les employés de la serre savent reconnaître les symptômes de la maladie et qu'ils ont reçu pour instruction d'alerter un responsable de la serre dès les premiers signes.
- Nouer un ruban de couleur sur les plants malades pour les signaler à l'attention des employés.
- Avertir les employés qu'ils peuvent disséminer les spores s'ils touchent avec leurs mains ou leurs vêtements des tiges infectées ou le substrat sur lequel des plantes malades ont poussé.
- Travailler dans les zones de la serre infectées par la maladie en dernier, après avoir travaillé dans les zones où la maladie n'a pas été observée.
- Ne pas déplacer les chariots et les cageots des zones infectées aux zones saines.
- Ne pas laisser de visiteurs entrer dans les zones atteintes.
Hygiène
Substrats de culture
- Éliminer les matelas, les sacs ou les cubes de substrat ou tout autre matériau dans lequel se sont trouvées des plantes infectées.
- Ne pas remettre en culture ces matériaux à moins de les avoir stérilisés à la vapeur.
- Jeter les ficelles qui ont servi à tuteurer des plantes malades parce qu'elles risquent d'héberger des spores.
- Si les poivrons ont été cultivés dans du terreau, désinfecter les banquettes.
- Si des substrats artificiels ont été utilisés, les rejeter loin de la serre ou les enfouir dans le sol.
Plants et débris de plants
- L'application d'une bonne hygiène dans la serre et la propreté des opérations de taille contribuent à contrecarrer le développement de la maladie. Comme il passe par un stade saprophyte, le champignon peut coloniser facilement les fruits, les fleurs ou les feuilles qui sont morts et, ensuite, former des fructifications qui émettront des spores sur ces tissus colonisés. Par conséquent, dans une serre où l'on a dépisté la maladie, il est très important de ne pas laisser des débris de plants de poivron traîner dans les allées.
- Éviter de manutentionner les plants et les fruits malades.
- Les retirer de la serre avec précaution, en faisant attention de ne pas laisser des parties malades de ces plants entrer en contact avec les plants voisins, et les déposer dans un sac en plastique.
- Rejeter les matériaux contaminés loin des serres pour éviter que l'inoculum du champignon ou les spores hivernantes subséquentes ne soient réintroduits dans les serres par les employés, le vent, les pneus et les insectes comme les éphydridés et les moucherons du champigon. En plus des plants malades, retirer environ 1 ou 2 plants sur chaque côté et les jeter dans des sacs à ordures.
- Si l'on dépose les matières végétales dehors sur un tas, le situer aussi loin que possible de la serre.
- Le tas de rebuts doit être recouvert pour empêcher les insectes comme les éphydridés et les moucherons du champignon de rapporter les spores du champignon dans les serres.
- On peut aussi incinérer les débris de plantes malades ou les envoyer dans un dépotoir.
- On ne doit pas les déposer à la surface d'un champ ni les enfouir dans le sol d'un champ cultivé, surtout si on doit y cultiver plus tard d'autres plantes sensibles, car le champignon a un large éventail d'hôtes et produit des spores hivernantes qui demeurent viables pendant des années.
- Si la maladie atteint un niveau grave dans la serre, il vaut mieux cueillir les fruits lorsqu'ils sont verts.
Désinfection générale
- À la fin de la saison, la serre doit être nettoyée à fond et désinfectée.
- On doit placer devant chaque entrée de la serre des pédiluves remplis d'une solution désinfectante que l'on renouvelle régulièrement.
- Les outils qui ont servi à tailler et à manutentionner des plantes infectées doivent être plongés dans une solution désinfectante après chaque contact avec des plants malades.
- Lorsqu'ils ont fini de travailler dans les zones infectées de la serre, les employés, surtout ceux qui entrent en contact avec des végétaux malades, doivent jeter à la poubelle les gants et les bottes à usage unique, envoyer les chaussures ou les bottes à la désinfection, et envoyer leur combinaison de travail à la lessive et à la désinfection.
- Les conduites du réseau goutte à goutte qui ont alimenté les plants malades et les piquets de soutien doivent être remplacés ou nettoyés par trempage dans un désinfectant commercial suivi d'un rinçage à l'eau.
Réglage des paramètres d'ambiance
- Éviter que se produisent des périodes d'humidité relative élevée (> 90 %) qui favorisent la libération des spores, surtout la nuit, en élevant la température lentement, heure par heure, de sorte que les fruits et les tiges atteignent les températures diurnes voulues avant le lever du soleil.
- Maintenir une bonne ventilation et un bon drainage pour éviter une humidité relative élevée, laquelle favoriserait la germination des ascospores.
- Régler le débit du goutte à goutte pour éviter une humidité excessive des blocs de laine minérale et réduire ainsi le risque de créer des conditions favorables à la libération des ascospores par les fructifications (périthèces) qui pourraient se trouver sur le substrat. L'humidité ou la sécheresse excessive des blocs de laine minérale favorise le développement de la pourriture fusarienne de la tige pour les différentes raisons évoquées plus haut.
Mesures de lutte biologique
Consulter la publication 836F du MAAARO intitulée La culture des légumes de serre, pour connaître les mesures de lutte biologique.
Remerciements
Nous tenons à remercier le Sécrétariat d'État pour sa contribution financière à la réalisation de la présente fiche technique.
Nous remercions également Gillian Ferguson, du MAAARO (Harrow), qui a assuré la relecture de la présente fiche technique et fourni les deux diapositives qui l'illustrent.