Échantillonnage du sol et des racines visant le dénombrement des nématodes phytoparasites
Renseignez-vous sur les nématodes, leur cycle de vie, les symptômes et la technique d’échantillonnage.
Aperçu
Les nématodes sont des organismes microscopiques qui ont la forme d’anguilles et qui vivent dans le sol et dans l’eau. Ce sont les organismes multicellulaires les plus abondants sur terre.
La plupart des nématodes terricoles sont des organismes utiles qui contribuent à décomposer la matière organique et à rendre biodisponibles les éléments nutritifs qu’elle renferme. Certains nématodes utiles exercent une prédation sur d’autres nématodes ainsi que sur des insectes, des champignons et des bactéries nuisibles vivant dans le sol.
Malheureusement, plusieurs espèces se nourrissent à la surface ou à l’intérieur de racines, de tiges et de bulbes, et occasionnent ainsi des baisses de rendement importantes dans les grandes cultures et les cultures horticoles pratiquées en Ontario (figure 1). Ils peuvent nuire directement à la santé des plantes ou indirectement en ouvrant un chemin dans le corps végétal pour d’autres phytopathogènes.

Les nématodes phytoparasites possèdent un stylet creux – une partie buccale ressemblant à une seringue hypodermique (figure 2). Une fois enfoncé dans les cellules végétales, le stylet injecte des enzymes qui décomposent le contenu des cellules. Le stylet sert aussi au nématode à retirer le contenu cellulaire partiellement digéré.
Les nématodes endoparasites, comme le nématode cécidogène et le nématode à kystes, se nourrissent à l’intérieur du tissu racinaire et passent une partie de leur cycle de vie attachés à la racine, tandis que les ectoparasites tels que les nématodes des lésions racinaires ou les nématodes annelés s’enfoncent dans la racine, se nourrissant et causant des dommages à partir de l’extérieur de la racine.

Source : Singh et Phulera (2015).
Nématodes phytoparasites en ontario
On trouve en Ontario plusieurs types différents de nématodes phytoparasites.
Il y a :
- le nématode à kystes du soya (Heterodera glycines)qui se propage dans différentes parties du sud-ouest ontarien
- le nématode à kystes de l’avoine (H. avenae)
- le nématode à kystes de la betterave (H. schachtii)
- le nématode cécidogène du nord (Meloidogyne hapla)
- le nématode des tiges et des bulbes (Ditylenchus dipsaci)
- le nématode à dague (Xyphinema sp.)
- le nématode des racines (Pratylenchus penetrans)
- le nématode annulaire (Mesocriconema xenoplax)
À l’exception du nématode à kystes de la betterave, qui peut infecter plus de 220 hôtes et notamment la plupart des crucifères cultivées, les nématodes à kystes ont généralement tendance à avoir une gamme restreinte d’hôtes.
Le nématode des tiges et des bulbes possède quant à lui un vaste éventail d’hôtes. Il existe plusieurs races de ce nématode qui, en général, n’est véritablement menaçant en Ontario que pour les cultures d’oignon et d’ail.
Le nématode cécidogène du nord possède lui aussi un vaste éventail d’hôtes; il s’attaque particulièrement aux carottes.
Le nématode des racines est considéré comme étant le nématode phytoparasite ayant la plus grande incidence économique sur les cultures de fruits et légumes en Ontario. Il parasite un vaste éventail d’hôtes, notamment de nombreuses espèces de mauvaises herbes indigènes.
Le nématode à dague et le nématode annelé sont présents dans la plupart des vergers du sud de l’Ontario, y compris les vergers de petites baies comme le bleuet et la fraise.
Cycle biologique des nématodes
Chez la plupart des nématodes phytoparasites, les femelles pondent leurs œufs dans le sol ou dans les racines, ou les gardent en elles dans des kystes. Une fois les œufs éclos, les jeunes nématodes nagent en direction de racines avoisinantes et s’en nourrissent.
Dans bien des cultures, les dommages causés par les nématodes ouvrent la voie à des infections par des organismes pathogènes, ce qui contribue à abaisser encore davantage les rendements.
Durant la saison de croissance, les nématodes complètent leur cycle biologique en 3 à 6 semaines, selon les conditions de température et d’humidité. Des conditions de température et d’humidité extrêmes contribuent à éliminer certaines espèces de nématodes.
Indices de la présence de nématodes
Les signes d’infestations par des nématodes diffèrent selon la culture et le type de nématode.
Les plantes endommagées par des nématodes sont habituellement réunies par plaques ou le long d’un rang. Les plants infestés paraissent rabougris, fanés et chétifs. L’alimentation des nématodes provoque l’apparition de symptômes comme :
- le jaunissement des tissus
- la torsion des tiges
- le gonflement des collets et des bulbes
- la formation de galles sur les racines ainsi que des racines fourchues et déformées
De fortes populations de nématodes phytoparasites dans le sol peuvent faire mourir les jeunes plants. Souvent, les dommages causés par les nématodes passent inaperçus en raison de la difficulté à diagnostiquer les dommages et les infestations, ce qui entraîne des pertes culturales de millions de dollars annuellement.
Les producteurs peuvent éviter ou réduire le risque de problèmes de nématodes dans leurs cultures en prélevant des échantillons de sol ou de racines au bon moment de l’année aux fins d’analyse des populations de nématodes. Un laboratoire qualifié accrédité doit effectuer ces prélèvements, pour recenser et dénombrer les nématodes.
Les nématodes des racines font apparaître sur les poils absorbants de minuscules lésions semblables à des égratignures, qui ouvrent la voie à des infections par des organismes terricoles responsables de la pourriture des racines (figure 3). Les nématodes des racines sont d’ailleurs souvent associés à des complexes de maladies dans lesquels interviennent d’autres agents pathogènes d’origine terricole qui contribuent à accroître l’incidence de la maladie et à abaisser les rendements de façon beaucoup plus marquée que lorsque les champignons pathogènes ou les nématodes sont seuls en cause. Certains nématodes parasites comme le nématode à dague sont des vecteurs de phytovirus.

La présence sur les racines de petites structures semblables à des perles le long des poils absorbants peut être l’indice d’une infestation par le nématode à kystes. Les petits kystes peuvent être blancs, jaunes ou bruns, selon l’espèce de nématode à kystes. Le nématode cécidogène du nord fait paraître les racines trapues et renflées et stimule à l’excès la croissance des racines secondaires, ce qui donne à la masse racinaire un aspect échevelé (figure 4).

L’apparition dans un champ de zones à l’intérieur desquelles les plants présentent des symptômes racinaires inhabituels ou une pourriture sévère des racines, ou encore l’apparition, par plaques, de plants qui dépérissent peut être le signe d’une infestation par des nématodes et justifie l’analyse d’échantillons de racines ou de sol.
Quand prélever les échantillons de racines
Les prélèvements d’échantillons de racines et de sol avec racines peuvent se faire en tout temps, à condition que le sol ne soit pas gelé. Cependant, les échantillons prélevés à l’automne seront idéaux pour l’identification des nématodes.
Pendant la saison de croissance activeles nématodes vivent et se nourrissent à l’intérieur ou le long des racines, surtout au cours des saisons chaudes et sèches. Durant la saison de croissance, pour faire confirmer un diagnostic d’infestation par des nématodes dans une zone en particulier d’une jeune culture, prélever séparément, de plants affichant des symptômes et de plants asymptomatiques, la motte racinaire au complet avec le sol qui l’entoure. Si un verger, un vignoble ou une culture vivace manque d’uniformité, creuser le sol et prélever soigneusement des échantillons de 10-20 g (poids frais) de poils absorbants sur les racines des sujets atteints et les soumettre à l’analyse.
Inutile de prélever des échantillons de racines sur des plants morts, car les nématodes les auront déjà désertées ou seront déjà morts. Placer les échantillons dans un sac de plastique à l’abri des rayons du soleil et dans un endroit frais pendant le transport vers le laboratoire de diagnostic.
Quand prélever les échantillons de sol
Le meilleur moment pour échantillonner le sol en vue d’en évaluer les populations de nématodes est le printemps une fois que le sol s’est réchauffé, ou l’automne, peu après la récolte. Ne pas prélever d’échantillons quand les champs sont très mouillés. La température idéale pour la collecte de nématodes dans le sol (pas trop sec) se situe entre 25 et 28 °C. Ne pas faire la collecte après une forte pluie.
Les champs qui ont déjà été infestés de nématodes peuvent être échantillonnés périodiquement afin de déterminer si les populations frôlent ou dépassent les seuils de nuisibilité économique.
Les populations de la plupart des nématodes phytoparasites dans le sol ont tendance à culminer en septembre et octobre une fois que la partie aérienne des cultures s’est fanée et est morte. C’est là le meilleur moment de l’année pour dénombrer les nématodes.
Un échantillonnage réalisé en début d’automne laisse le temps aux producteurs de décider si la fumigation doit se faire à l’automne ou au printemps, ou quelle culture ils doivent pratiquer le printemps suivant. Il leur laisse aussi le temps de mettre en œuvre un programme de lutte intégrée avant d’utiliser le champ pour une culture sensible. L’échantillonnage réalisé au printemps avant les semis peut également être fiable.
Où prélever les échantillons
Les points de prélèvement des échantillons de sol destinés à l’évaluation des populations de nématodes dépendent de :
- la raison de l’échantillonnage du sol
- du type de culture pratiquée dans le champ
- du type de nématodes visés par l’échantillonnage
Si l’échantillonnage qui doit servir au dénombrement des nématodes vise à diagnostiquer un problème dans une culture en rangs au cours de la saison de croissance, prélever 8-10 carottes de sol à proximité de plants malades ou sur le pourtour de zones gravement atteintes. À des fins de comparaison, prélever séparément 8-10 autres carottes de sol autour de plants sains (figure 5).
Lors de l’échantillonnage du sol effectué dans des cultures en rangs au cours de la saison de croissance, dans des plantations d’arbres ou dans des cultures vivaces, il est très important d’inclure des poils absorbants dans l’échantillon de sol, car beaucoup de nématodes y vivent.
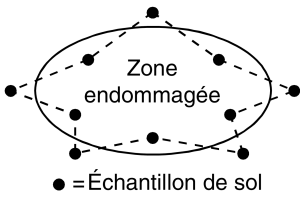
Dans le cas d’arbres fruitiers ou d’arbustes ornementaux individuels qui sont soupçonnés d’être infestés de nématodes, il vaut mieux prélever les échantillons de sol sur le pourtour du feuillage, et dans les zones situées situées entre les extrémités des branches et le tronc (figure 6).
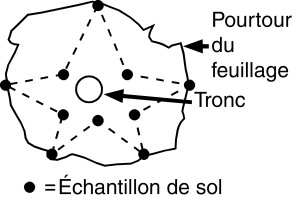
Lorsque l’échantillonnage vise à déterminer si la population de nématodes a atteint le seuil de nuisibilité économique dans une culture en rangs, prélever les échantillons de sol sur le rang, autour de plants en croissance active, afin d’obtenir des échantillons qui renferment des poils absorbants (figure 7).
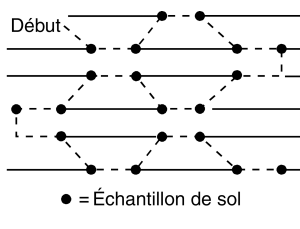
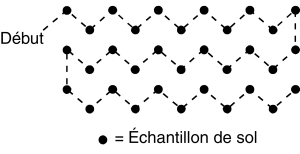
Quand les échantillons sont prélevés à l’automne dans des champs en jachère une fois le feuillage fané ou au printemps avant les semis, il vaut mieux prélever les échantillons en parcourant le champ suivant un tracé en Z, en W ou en M (figure 8). Un même échantillon de sol ne doit pas représenter plus de 2,5 ha.
Comment échantillonner le sol
Les nématodes sont rarement répartis uniformément dans un champ, sans compter que leurs populations fluctuent au cours de la saison de croissance. Nettoyer la zone d’échantillonnage, pour augmenter les chances que l’échantillon contienne uniquement du sol en enlevant toute couverture. Prélever les échantillons de sol à environ 25 à 30 cm de profondeur à l’aide d’une tarière de 2,5 cm (1 po) de diamètre (figure 9).

- Nettoyer la zone supérieure.
- Préparer une sonde de 2,5 cm pour l’échantillonnage du sol.
- Enfoncer la sonde 30 cm dans le sol.
- Retirer la sonde.
- Enlever les 3 cm à 5 cm supérieurs de terre et mettre le reste dans un sac d’échantillonnage.
Les échantillons de sol peuvent aussi être prélevés à l’aide d’une pelle étroite ou d’une truelle; toutefois, cette méthode est moins fiable que l’utilisation de la tarière. Les saisons marquées par des conditions extrêmes de pluie, de sécheresse, de chaleur ou de froid peuvent avoir une influence sur les niveaux de populations, surtout dans les 2,5 à 5 premiers cm (1 à 2 po) de sol, d’où l’importance d’éliminer cette couche superficielle de sol, que les nématodes fuient normalement en pareilles conditions.
Recueillir les carottes de sol dans un seau propre, bien mélanger le sol mais avec délicatesse et le déposer dans un contenant ou un sac de plastique étiqueté. Ne jamais laisser un échantillon de sol exposé à des températures très chaudes ni s’assécher. Conserver les échantillons de sol dans une glacière bien pourvue en glaçons jusqu’au moment de leur transfert dans une chambre froide ou de leur analyse.
Nombre de carottes de sol par unité de superficie
Le nombre de carottes de sol nécessaires pour évaluer les niveaux de populations de nématodes dépend de la superficie échantillonnée (tableau 1).
| Zone | Nombre de carottes de sol/échantillon |
|---|---|
| < 500 m2 | 8 à 10 |
| 500 m2 – 0,5 ha | 25 à 35 |
| 0,5 ha – 2,5 ha | 50 à 60 |
L’échantillon soumis au laboratoire ne doit jamais représenter plus de 2,5 ha. Il faut tout juste suffisamment de sol pour donner une idée représentative de la population dans le sol.
Le tableau 1 indique combien de carottes sont nécessaires pour obtenir un échantillon représentatif. Si le profil de sol varie dans un même champ, prélever des échantillons distincts pour chaque profil de sol. Envoyer les échantillons de sol à une clinique ou à un laboratoire de diagnostic apte à isoler, à identifier et à dénombrer les nématodes.
Confirmer que le laboratoire de diagnostic peut identifier tous les nématodes phytoparasites présents dans les échantillons de sol. Selon le protocole d’extraction des nématodes, l’échantillon peut ne pas conserver toutes les tailles de nématodes, ce qui signifie que des informations importantes seront probablement manquées. Par exemple, les nématodes plus gros, comme le nématode à dague et le nématode annelé, peuvent être sous-représentés dans l’échantillon si la méthode d’extraction normale (méthode de Baermann à assiette) est utilisée pour isoler les nématodes.
Seuil de nuisibilité économique
Les seuils de nuisibilité économiques sont déterminés d’après les populations initiales qui gonfleront au fil de la saison de croissance et qui causeront des dommages ayant une incidence économique. Le seuil de nuisibilité économique correspond au nombre de nématodes par kilogramme de sol. Ce seuil est souvent différent d’une culture à l’autre et pour chaque espèce de nématode (tableau 2).
| Nématode | Seuil de nuisibilité économique : Sol (nématodes/kg de sol) | Seuil de nuisibilité économique : Racines (nématodes/50 g de racines sèches) | Cultures |
|---|---|---|---|
| Des racines | 500 | S. O. | Fraisier |
| Des racines | 2,000 | S. O. | Cultivars de tomates de transformation à croissance vigoureuse |
| Des racines | 1,000 | 50 | La plupart des autres cultures |
| Cécidogène | 0 | 0 | Carotte, panais, tomate |
| Cécidogène | 500 | S. O. | Oignon, pomme de terre |
| Cécidogène | 1,000 | S. O. | La plupart des autres cultures |
| Du pin | 5,000 | S. O. | La plupart des cultures |
| À dague | 100 | S. O. | La plupart des cultures |
| Des tiges et des bulbes | 100 | S. O. | La plupart des cultures |
| De la betterave | 2,000 larva or eggs (> 250 cysts) | S. O. | Betteraves à sucre, crucifères |
| À kystes du soya | 2,000 larva or eggs (> 250 cysts) | S. O. | Soya |
Lorsque le seuil de nuisibilité est atteint, que celui soit aussi élevé que 1000 nématodes des racines/kg de sol, comme dans le cas de la plupart des légumes, ou aussi faibles que 500/kg de sol, comme dans le cas des fraisiers, les pertes de rendement peuvent être considérables. Si le rapport d’analyse de sol indique des populations de nématodes supérieures au seuil établi, la mise en œuvre d’une stratégie de lutte intégrée contre les nématodes s’impose.