Les thrips dans les cultures de serre : biologie, dommages et lutte
Renseignez-vous sur le cycle biologique, les dommages et les moyens de lutte associés aux thrips dans les cultures de serre.
Introduction
Les thrips sont des ravageurs importants des cultures de serre en Ontario. Un certain nombre d’espèces y sont répandues, notamment le thrips des petits fruits (Frankliniella occidentalis), le thrips des fleurs (Frankliniella tritici), le thrips de l’oignon (Thrips tabaci) et Echinothrips. Toutefois, c'est le thrips des petits fruits qui est l’espèce prédominante et la plus difficile à combattre (figure 1).

Le thrips des petits fruits adulte fait environ 1-2 mm de long et est en général brun jaunâtre. L’identification de l’espèce n'est pas chose facile (surtout s'il s'agit de distinguer le thrips des petits fruits du thrips des fleurs ou du thrips de l’oignon), à cause de la petite taille des individus et de leur couleur variable. Seul le stade adulte permet d’identifier l’espèce. On devrait confier l’identification à des spécialistes.
Cycle biologique
Le cycle biologique comprend cinq stades : œuf, larve, prépupe, pupe et adulte. La femelle adulte du thrips des petits fruits vit jusqu'à 30 jours et pond de 2 à 10 œufs/jour. Le passage de l’œuf à l’adulte prend environ 19 jours à 20 °C et seulement 13 jours à 25 °C. Les œufs sont insérés dans des tissus végétaux mous - fleurs, feuilles, tiges et fruits. Chez le poivron, l’éclosion des œufs donne aux feuilles un aspect moucheté, le degré de moucheture correspondant au nombre d’œufs éclos. La larve passe par deux stades larvaires (figure 2) au cours desquels elle se nourrit et se développe sur les feuilles, fleurs et fruits. La prépupaison et la pupaison s'effectuent souvent au sol ou dans le substrat, mais la pupaison peut aussi avoir lieu sur le plant. La pupe (figure 3) ne s'alimente pas; ce stade est celui où les ailes et structures adultes se forment.


Les adultes volent avec peine, habituellement sur de courtes distances, d’une feuille à l’autre ou d’un plant à l’autre, ce qui ne les empêche pas de se disperser rapidement à la grandeur d’une serre. Les thrips adultes peuvent être portés par les vents et pénétrer dans la serre par les orifices de ventilation et les portes. À tous les stades, ils peuvent être dispersés par les vêtements des travailleurs et le déplacement de substrat, d’instruments aratoires et de plants infestés.
Dommages
Les individus des stades adulte et larvaires se nourrissent en perçant les tissus des végétaux au moyen de leurs pièces buccales et en suçant le contenu des cellules végétales. À l’emplacement des cellules mortes, se forment des taches blanches ou brunes auxquelles s'ajoutent des matières fécales foncées laissées par les thrips.
Cultures légumières
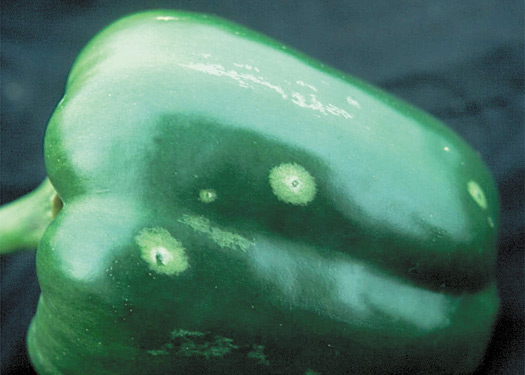
Chez le concombre (figure 4) et la tomate, les dommages causés par les thrips apparaissent d’abord sur les feuilles inférieures des plants, tandis que chez le poivron (figure 5), ils apparaissent d’abord sur les feuilles les plus jeunes dans le haut des plants. Les infestations graves réduisent la capacité photosynthétique des plants et, du coup, leur rendement. Sur les pétales des fleurs des espèces légumières, l’alimentation des thrips laisse des stries blanc argenté. Les dommages sur les fruits varient selon la culture. Les concombres souffrent d’une déformation grave, sont enroulés ou sont striés de blanc (figure 6). Les poivrons (figure 7) présentent des stries ou des taches argentées ou bronze. Les thrips se nourrissent aussi du calice qui, en se soulevant, expose le fruit aux infections bactériennes. Chez la tomate, il arrive que les thrips pondent des œufs dans le fruit laissant celui-ci marqué de taches spectrales (figure 8). Des taches spectrales peuvent aussi apparaître sur les poivrons et les concombres.




Cultures ornementales
Le thrips des petits fruits s'attaque à des centaines d’espèces végétales, dont de nombreuses cultures florales commerciales. Les symptômes se manifestent notamment par la déformation des feuilles et des cicatrices causées par l’alimentation (figures 9 et 10). Particulièrement friands de fleurs, les thrips laissent des stries et des cicatrices sur les pétales, déforment fleurs et boutons floraux et empêchent les pétales de se déployer complètement (figures 11 et 12).




Transmission des virus
Le thrips des petits fruits est le principal vecteur d’un groupe de virus, appelés tospovirus, dont les plus fréquents dans les serres sont le virus de la maladie bronzée de la tomate et le virus des taches nécrotiques de l’impatiente. Généralement, en Ontario, le virus de la maladie bronzée de la tomate se retrouve dans les cultures légumières et dans quelques cultures ornementales, comme le chrysanthème, tandis que le virus des taches nécrotiques de l’impatiente infecte davantage les cultures ornementales. Dans les cultures légumières, bien que les symptômes du virus de la maladie bronzée de la tomate varient selon l’hôte, le cultivar et le stade phénologique, ce virus peut freiner considérablement la croissance ou même l’arrêter. Les autres symptômes sont : rabougrissement, bronzage et enroulement des feuilles, déformation des organes atteints, fruit difforme mûrissant inégalement et présentant souvent des taches nécrotiques en anneaux (figures 13 et 14).


De nombreuses espèces ornementales servent d’hôtes au virus des taches nécrotiques de l’impatiente. Elles n'affichent pas toutes la même sensibilité ni les mêmes symptômes. Voici un aperçu de ces derniers (figures 15 à 20) :
- taches en anneaux et lignes sur les feuilles,
- lésions nécrotiques,
- stries noires sur les nervures et les tiges,
- rabougrissement,
- mort des points végétatifs et du collet,
- mort du plant chez certaines espèces (p. ex., le gloxinia).






Lutte
Surveillance
La réussite de tout programme de lutte contre le thrips des petits fruits repose sur la surveillance des densités de population. Dans les cultures légumières, la surveillance doit débuter dès la production des plantules et se poursuivre au delà du repiquage. Dans les cultures florales, les thrips peuvent être présents toute l’année à des niveaux de population nuisibles, quoique, généralement, les populations soient moins fortes pendant l’hiver. On peut surveiller les densités de population de thrips adultes à l’aide de plaquettes collantes, bleues ou jaunes (figure 21), qu'on trouve sur le marché. Les plaquettes bleues attirent surtout les thrips des petits fruits, tandis que les plaquettes jaunes attirent surtout d’autres insectes, comme les aleurodes et les pucerons. Le choix de la plaquette dépend du nombre d’espèces différentes de ravageurs à surveiller, de la sensibilité de la culture aux thrips et/ou aux tospovirus, et de la nécessité de détecter les thrips dès le début d’une infestation.

Pour mettre en œuvre un programme de surveillance, il faut utiliser une plaquette par 100-200 m2 de serre. Le nombre exact de plaquettes variera selon la configuration de la serre. À surface égale, une grande serre non cloisonnée exige une densité totale de plaquettes moins élevée qu'une serre subdivisée en plusieurs petites sections. Diviser mentalement la serre en carrés égaux et placer une plaquette au milieu de chacun. Vérifier les plaquettes chaque semaine et noter le nombre moyen de captures de thrips par plaquette. Ce décompte ne donne pas une mesure absolue de la population; il permet plutôt d’en suivre les augmentations et diminutions, tout au long de l’année. Au fur et à mesure qu'on comprend mieux la relation entre les décomptes et la densité de la population présente dans la culture, on peut s'aider de ces données de surveillance pour décider des mesures de lutte à prendre. Dans les cultures ornementales de serre, une inspection visuelle des fleurs simples, comme les impatientes, peut donner une bonne idée du nombre de thrips dans la culture. Toutefois, lorsqu'il s'agit de fleurs plus complexes, le décompte visuel peut être moins fiable. Des programmes d’échantillonnage ont été mis au point pour déterminer, à des niveaux de précision fixes, les populations de thrips des petits fruits adultes dans les fleurs des cultures de concombre et de poivron de serre. Le nombre des échantillons à prendre varie en fonction du niveau de population du ravageur, mais ces programmes d’échantillonnage permettent de prédire avec exactitude la densité du ravageur avec des niveaux de précision (marges d’erreur) fixes. Avant de mettre en œuvre un programme de surveillance, s'adresser à un spécialiste de la lutte contre les ennemis des cultures de serre, auprès du MAAARO, ou à un conseiller en lutte intégrée (LI) pour de l’information plus détaillée.
Lutte culturale
La propreté générale de la serre est le préalable le plus important de tout programme de lutte antiparasitaire efficace. Des mesures d’hygiène rigoureuses permettent de réduire, voire d’éliminer, les infestations de thrips. Par exemple, dans les cultures de roses à couper, la suppression de tous les boutons floraux (y compris les fleurs invendables) peut réduire sensiblement les populations de thrips. Font également partie de la lutte culturale toutes les mesures qui préservent la santé de la culture et qui maintiennent une ambiance optimale pour celle-ci (par exemple, une humidité relative de 80 %), mais qui sont peu propices à un gonflement rapide des populations de thrips.
Lutte physique
Un programme de lutte intégrée peut être rapidement dépassé par l’arrivée massive de ravageurs, dont les thrips, dans une serre, ce qui complique pour le producteur la planification de ses mesures de lutte. Le producteur a donc intérêt à installer des moustiquaires pour freiner la pénétration des ravageurs dans la serre. Pour plus d’information sur la pose de moustiquaires, voir la fiche technique du MAAARO, Pose de moustiquaires pour exclure les insectes des serres.
Lutte biologique
Étant donné que les thrips ont développé une résistance à la plupart des pesticides homologués, la lutte biologique reste maintenant la principale stratégie de lutte contre les thrips dans les cultures de serre. Les agents de lutte biologique comprennent des acariens prédateurs, tels que :
- Neoseiulus (= Amblyseius) cucumeris;
- Amblyseius swirskii;
- Iphesius (= Amblyseius) degenerans;
- Stratiolaelaps scimitus (= Hypoaspis miles);
- Gaeolaelaps gillespiei;
- Gaeolaelaps aculeifer (= Hypoaspis aculeifer);
- les punaises anthocorides (Orius insidiosus);
- les nématodes (Steinernema feltiae);
- le champignon entomopathogène Beauveria bassiana.
N. cucumeris (figure 22) et A. swirskii sont les acariens prédateurs les plus largement utilisés. Ils se ressemblent beaucoup. Ces acariens maîtrisent les thrips des petits fruits sur le feuillage en se nourrissant des larves du premier stade larvaire. A. swirskii peut aussi se nourrir, dans une moindre mesure, des thrips du deuxième stade larvaire. Il faut attendre un certain nombre de semaines avant de voir les effets de leur prédation dans la serre et on ne peut pas espérer une élimination totale des populations de thrips. N. cucumeris met environ 10 jours pour accomplir son cycle biologique à la température de 20 °C et environ 6 jours à 25 °C. A. swirskii a besoin de plus de chaleur pour son développement qu'N. cucumeris et donne par conséquent de meilleurs résultats dans des conditions estivales. Son cycle biologique a la même durée que celui d'N. cucumeris, mais il dépend du nombre et du type de proies disponibles.

Il faut introduire les acariens prédateurs dans la serre dès qu'on y décèle des thrips. L’application de bonnes mesures d’hygiène au début et à la fin de chaque saison de croissance est d’une importance décisive, car elle contribue à retarder le développement d’une infestation jusqu'au moment où les auxiliaires biologiques sont aptes à la contrer. Les introductions dans la serre de N. cucumeris ou d'A. swirskii doivent se faire à intervalles réguliers à l’aide d’un mélange de son et d’acariens que l’on saupoudre directement sur les plants ou le substrat, ou à l’aide de sachets d’élevage à libération lente qu'on suspend au-dessus des plants (figure 23). La méthode des sachets permet une libération continue des prédateurs parmi les plants. Les sachets d’élevage doivent être renouvelés chaque mois. En horticulture ornementale, bien des producteurs ont maintenant recours aux mini-sachets à libération lente qu'on trouve depuis peu sur le marché. Ceux-ci sont beaucoup moins coûteux et peuvent être fixés à des contenants individuels (p. ex., des paniers suspendus ou même des pots de 15 cm). L’application d’une source de nourriture d’appoint, comme du pollen de pommier aux chrysanthèmes peut favoriser l’établissement d'A. swirskii quand les populations de thrips sont faibles. La fréquence à laquelle il faut apporter des acariens dans la serre dépend de la culture et du niveau d’infestation par les thrips (consulter un spécialiste de la lutte contre les ennemis des cultures de serre, auprès du MAAARO, ou un conseiller en lutte intégrée). L’infestation devrait être circonscrite au bout de cinq à neuf semaines. L’utilisation des prédateurs N. cucumeris ou A. swirskii oblige à prendre deux précautions importantes : maintenir l’humidité relative de la serre à au moins 70 %; ne pas employer de pesticides persistants pendant les mois qui précèdent leur introduction.

La punaise anthocoride Orius maîtrise efficacement les thrips (figure 24). Contrairement à N. cucumeris et à A. swirskii, Orius dévore les thrips à tous leurs stades de développement. On la découvre souvent au cœur des boutons floraux, car le pollen est sa nourriture de rechange. Étant donné que le pollen n'est pas souvent présent dans les cultures ornementales, Orius n'est pas aussi efficace dans les cultures florales que dans les cultures légumières. Des études récentes montrent toutefois que le poivron ornemental peut servir de plante relais (aussi appelée plante « banque », « refuge » ou « réservoir ») pour Orius dans d’autres cultures ornementales, ce qui permet à une population de s'établir, de se développer et de se disperser à l’intérieur de la serre. Certains producteurs de cultures ornementales et légumières ont recours à cette stratégie pour tirer parti de la prédation offerte par Orius. Cette punaise anthocoride met 31 jours pour passer du stade de l’œuf au stade adulte à la température de 20 °C et 19 jours à 25 °C. Elle entre en diapause reproductive quand la durée d’éclairement tombe à moins de 12 heures par jour. De ce fait, Orius est un agent de lutte qui n'est efficace que de mars à septembre.

L’idéal est de faire les lâchers d'Orius quand les infestations sont faibles. En général, un ou deux lâchers suffisent à maîtriser les thrips au bout d’environ 3 à 5 semaines, selon le degré d’infestation et le type de culture hôte. Dans les cultures légumières de serre, Orius donne un maximum de résultats dans les cultures de poivrons et de concombres. On introduit les adultes en plusieurs endroits de la serre, d’où ils se dispersent naturellement en volant. L’échantillonnage des fleurs est la meilleure méthode pour contrôler la présence d'Orius.
Iphesius degenerans (figure 25) diffère de N. cucumeris et d'A. swirskii par son aspect et son aptitude à tolérer des ambiances moins humides. Cet insecte de couleur sombre, très agile, se reproduit très bien sur le pollen. Comme son action prédatrice est maximale dans les cultures qui offrent une source de pollen (p. ex., dans les poivrons de serre), cet auxiliaire de lutte n'est certainement pas la meilleure option pour les cultures florales.

Stratiolaelaps scimitus et Gaeolaelaps gillespiei (figure 26) sont des acariens prédateurs terricoles qui se nourrissent de toutes sortes d’organismes qu'ils trouvent dans la terre, dont les pupes de thrips. On ajoute l’un ou l’autre une seule fois au substrat (p. ex., laine de roche, mélanges à base de tourbe), au moment de la mise en culture. Bien qu'il soit difficile de déterminer avec précision l’effet de ces prédateurs sur les populations de thrips, des études indiquent qu'ils peuvent tuer jusqu'à 30 % des pupes. Comme ils ne suffisent probablement pas à eux seuls à maîtriser les thrips, il vaut mieux les utiliser avec d’autres prédateurs.

En Ontario, les producteurs d’espèces ornementales recourent fréquemment aux nématodes. Selon des études menées en Ontario et en Europe, les nématodes détruisent efficacement les pupes de thrips lorsqu'ils sont appliqués chaque semaine sur le substrat. Pour rationaliser les coûts, l’idéal est d’appliquer les nématodes par aspersion dans les serres de propagation quand les racines ont envahi les pots au complet.
Beauveria bassiana est un champignon pathogène qui s'attaque aux thrips. On le mélange habituellement à de l’eau et on l’applique par pulvérisation. Comme de nombreux champignons, celui-ci est plus efficace quand l’humidité est forte. Par conséquent, pour traiter les plantes ornementales, on l’applique le plus souvent dans la serre de propagation. Dans des cultures légumières, on peut soit le pulvériser sur la culture, soit laisser les bourdons se charger de le disséminer depuis des ruches pourvues de plateaux de distribution. Ces plateaux contiennent des spores de Beauveria bassiana qui sont diluées dans un support pulvérulent. Forcés de fouler la surface des plateaux au sortir de la ruche, les bourdons s'enduisent un peu à chaque fois du mélange contenant les spores. Les spores se distribuent ainsi dans la culture à la faveur du butinage quand les bourdons, en quête de nectar et de pollen, pollinisent les cultures. Quand les thrips entrent en contact avec les spores à la surface des cultures, ils deviennent infectés et meurent.
Lutte chimique
La lutte contre le thrips des petits fruits par des moyens chimiques peut être difficile, car ce ravageur est résistant à la plupart des pesticides. En outre, ses larves se tiennent au fond des boutons floraux ou sur les feuilles encore repliées pour s'y nourrir. Ces caractéristiques font en sorte que le thrips des petits fruits est une cible difficile à atteindre par les insecticides. Les pulvérisations doivent donc couvrir de façon homogène toutes les parties des plants. Les consignes générales à suivre dans l’emploi de pesticides pour combattre les thrips sont les suivantes :
- Commencer les applications tôt, avant que les thrips pullulent. Il est plus facile de les combattre quand leurs populations sont faibles.
- Bien qu'il soit important d’utiliser en alternance des pesticides appartenant à des groupes chimiques différents, n'utiliser qu'un seul groupe chimique pendant la durée d’un cycle biologique des thrips. Cela veut dire qu'il faut changer de groupe chimique toutes les 2-3 semaines, cet intervalle variant selon l’époque de l’année.
- Pulvériser les pesticides tôt le matin ou tard l’après-midi, moments où les thrips sont le plus actif et le plus susceptible d’entrer en contact avec le produit.
Pour plus d’information
Pour plus d’information, voir la publication 370F du MAAARO, Guide de la culture des fleurs et des plantes d’ornement en serre, ou la publication 835F, Guide de protection des légumes de serre.
La version anglaise de la présente fiche technique a été rédigée par Graeme Murphy, spécialiste de la lutte intégrée contre les ennemis des cultures floricoles en serre, Division du développement économique, MAAARO, Vineland, Gillian Ferguson, spécialiste de la lutte intégrée contre les ennemis des cultures légumières en serre, Division du développement économique, MAAARO, Harrow, et Les Shipp, entomologiste des cultures de serre, Agriculture et Agroalimentaire Canada, Harrow.